
Zusammenfassung von Dr. Rudolf Hüster

Ergebnisse
Mit dem Ziel, die saisonale Natur von COVID-19 zu bewerten, wurde der Krankheitsverlauf bei 6.914 Personen, die in Krankenhäusern in Europa und China aufgenommen wurden, ausgewertet. Da es kein Standardmaß oder eine Klassifizierung des COVID-19-Schweregrads gibt, die in allen Krankenhäusern verwendet wird, wurden die Dauer des Krankenhausaufenthalts, die Notwendigkeit der Intensivstation und separat die mechanische Beatmung verglichen. Somit liegt der Schluss nahe, dass COVID-19 als Krankheit einen starken saisonalen Charakter hat. Die meisten Atemwegsviren erreichen ihren Höhepunkt im Winter, und die Fluktuation von Temperatur und Luftfeuchtigkeit wurde als die stärksten Treiber der Saisonalität vorgeschlagen. Das saisonale Auftreten von Atemwegsviren wird häufig dem saisonalen Auftreten in Innenräumen und den Auswirkungen von Temperatur und Luftfeuchtigkeit auf die Stabilität der Viruspartikel zugeschrieben, wobei die Auswirkungen einer niedrigen Luftfeuchtigkeit auf die Schleimhautbarriere häufig vernachlässigt werden. Obwohl Schleim oft als physikalische Barriere betrachtet wird, ist er in Wirklichkeit eine aktive biologische Barriere, die Viren und Bakterien mit Mucinen verklebt. Mucin-Glykane fangen somit virale Partikel ab, die dann aus den Atemwegen abtransportiert werden. Diese Barriere ist jedoch nur funktionsfähig, wenn sie gut hydratisiert ist, um sowohl ihre strukturelle Integrität zu erhalten als auch einen konstanten Fluss von Schleim, der Viren und andere Krankheitserreger aus unseren Atemwegen entfernt. Wenn sie trockener Luft ausgesetzt sind, trocknen diese Barrieren aus und können ihre Schutzfunktionen nicht erfüllen (26). In Tierversuchen wurde die Bedeutung der Luftfeuchtigkeit sowohl für die Übertragung von Atemwegsviren als auch für den Schweregrad der Erkrankung nachgewiesen, In den USA wiesen Studien auf auf die Bedeutung der Luftfeuchtigkeit für die Influenzaübertragung hin. Eine dieser Studien zeigte, dass eine Erhöhung der relativen Luftfeuchtigkeit von 20 auf 50 % die Sterblichkeit durch Influenza-Infektionen signifikant senken kann. Epithelzellen der Nasenschleimhaut sind das Hauptportal für die Erstinfektion und Übertragung von SARS-CoV-2.
Schlussfolgerungen
Die Daten der Studie deuten darauf hin, dass neben dem Einfluss auf die Virusübertragung auch Umweltfaktoren bei bereits infizierten Patienten eine wichtige Rolle spielen. Der Schweregrad von COVID-19 nahm mit dem Einsetzen des Frühlings ab, was ein düsteres Bild für den kommenden Winter zeichnet und darauf hindeutet, dass sowohl der Schweregrad der Erkrankung als auch die Sterblichkeit deutlich ansteigen könnten. Da in vielen Krankenhäusern im Winter eine sehr trockene Luft herrscht, könnte es von Vorteil sein, den Patienten in frühen Krankheitsstadien befeuchtete Luft zuzuführen. In Anbetracht der offensichtlich schädlichen Wirkung von trockener Luft auf unsere Schleimhautbarriere und deren Rolle als erste Verteidigungslinie gegen Infektionen wäre es bei einer schnell fortschreitenden COVID-19-Pandemie unerlässlich, eine universelle Befeuchtung der trockenen Luft in allen öffentlichen und privaten beheizten Räumen sowie eine aktive Nasenhygiene und Hydratation aktiv zu fördern. Die Luftfeuchtigkeit sollte auch in gekühlten Gebäuden mit eingeschränktem Zugang zur Außenluft überwacht werden, da Klimaanlagen ebenfalls eine effektive Entfeuchtung darstellen und zu sehr trockener Luft führen können.
Einführung
Die meisten Atemwegsviren zeigen eine ausgeprägte Saisonabhängigkeit, für SARS-CoV-2 muss dies jedoch noch dokumentiert werden. Methoden: Wir untersuchten den Krankheitsverlauf von COVID-19 bei 6.914 Patienten, die in Krankenhäusern in Europa und China aufgenommen wurden. Zusätzlich haben wir den Verlauf der Krankheitssymptome bei 37.187 Personen ausgewertet, die Symptome in der App COVID- Symptom Study gemeldet haben.
Befunde: Eine Meta-Analyse des Sterblichkeitsrisikos in sieben europäischen Krankenhäusern schätzte die Chancenverhältnisse pro Verlängerung des Aufnahmedatums um 1 Tag auf 0,981 (0,973 – 0,988, p < 0,001) und pro Anstieg der Umgebungstemperatur um 1°C auf 0,854 (0,773 – 0,944, p = 0,007). Statistisch signifikante Rückgänge in vergleichbarer Größenordnung bei der durchschnittlichen Krankenhausverweildauer, der Wahrscheinlichkeit einer Verlegung auf die Intensivstation und der Notwendigkeit einer mechanischen Beatmung wurden ebenfalls in den meisten, aber nicht allen Krankenhäusern beobachtet. Die Analyse der individuell berichteten Symptome von 37.187 Personen in Großbritannien zeigte auch die Abnahme der Symptomdauer und der Krankheitsschwere mit der Zeit. Auslegung: Der Schweregrad von COVID-19 in Europa nahm zwischen März und Mai signifikant ab und die Saisonabhängigkeit von COVID-19 ist die wahrscheinlichste Erklärung.
Hintergrund
Bis zum 1. Oktober 2020 wurden mehr als eine Million COVID-19-bedingte Todesfälle gemeldet, aber eine beträchtliche Anzahl der mit SARS-CoV-2 infizierten Menschen (in manchen Bevölkerungsgruppen über 80 %) schafft es, die Infektion in den oberen Atemwegen einzudämmen und entwickelt trotz PCR-positiver viraler RNA keine sichtbaren Symptome (1). Bisher wurde den Auswirkungen von Umweltbedingungen auf den individuellen Verlauf der Krankheiten nur wenig Aufmerksamkeit geschenkt. Die erste Studie zu den Umwelteinflüssen auf die COVID-19-Infektionsrate in 30 chinesischen Provinzen fand signifikante negative Zusammenhänge mit der Temperatur und der relativen Luftfeuchtigkeit in der Provinz Hubei mit einem Rückgang der Fälle um 36 – 57% für jedes 1 ◦C und 11 – 22% für jeden 1 %igen Anstieg der relativen Luftfeuchtigkeit; diese Zusammenhänge waren in anderen Provinzen nicht einheitlich (2). Negative Auswirkungen auf die COVID-19-Übertragung bei wärmeren Temperaturen wurden auch in der Türkei beobachtet (3), Mexiko (4), Brasilien (5), und Vereinigte Staaten (6), während ein ähnlicher Zusammenhang mit der Luftfeuchtigkeit in Australien berichtet wurde, wobei die Temperatur jedoch keinen Einfluss auf die Virusübertragung hatte (7). Die Studie aus Brasilien beobachtete eine Abflachung der Temperaturauswirkungen auf die Virusübertragung bei 25,8 ◦C, was darauf hindeutet, dass wärmeres Wetter nicht zu einem Rückgang der Übertragung führt, was mit den Studien aus dem Iran und Spanien übereinstimmt, wo keine Veränderungen der Übertragungsraten bei unterschiedlichen Temperaturen und Luftfeuchtigkeit beobachtetet wurden (8, 9). Diese Studien sind widersprüchlich und geben keinen eindeutigen Hinweis darauf, ob es einen Zusammenhang zwischen Temperatur, Luftfeuchtigkeit und Virusübertragung gibt. Die globale Betrachtung scheint eine klarere Schlussfolgerung zu liefern; alle drei Studien, die eine Analyse auf globaler Ebene durchführten, fanden einen Zusammenhang zwischen höherer Luftfeuchtigkeit, wärmeren Temperaturen und einer geringeren Übertragungsrate (10). Klimaabhängige Epidemie-Modellierungen legten jedoch nahe, dass die fehlende Immunität der Bevölkerung ein viel stärkerer Faktor für die Virusübertragung ist und dass sommerliche Temperaturen die Ausbreitung der COVID-19-Pandemie nicht wesentlich einschränken werden (11). Dies steht im Einklang mit der hohen Anzahl infizierter Personen in tropischen Ländern und dem Anstieg der Fälle im Süden der Vereinigten Staaten in der zweiten Hälfte des Monats Juni 2020.
Neuere Studien berichten über eine steigende Anzahl von SARS-Cov-2-positiven asymptomatischen Personen (1), aber es ist nicht klar, ob die offensichtliche Zunahme von Personen mit milden oder keinen Symptomen auf den veränderten Umfang der Tests oder auf eine andere Eigenschaft des SARS-CoV-2-Virus zurückzuführen ist. Mit dem Ziel, den Zusammenhang von Luftfeuchtigkeit und Umgebungstemperatur mit dem Schweregrad der COVID-19-Erkrankung zu untersuchen, analysierten wir die individuellen Patientendaten von 6.914 Patienten mit COVID-19, die seit Beginn der Pandemie in Krankenhäuser in Bergamo (Italien), Barcelona (Spanien), Coburg (Deutschland), Helsinki (Finnland), Mailand (Italien), Nottingham (Großbritannien), Warschau (Polen), Zagreb (Kroatien) und der Provinz Zhejiang (China) eingeliefert wurden, und verglichen sie mit der Umgebungstemperatur und der berechneten Luftfeuchtigkeit in Innenräumen. Darüber hinaus analysierten wir Informationen über den Schweregrad von COVID-19 aus der App COVID Symptom Study, die Informationen von 37.187 Personen in Großbritannien sammelt.
Methoden
Untersuchte Kohorten
Wir sammelten Informationen über Krankenhausaufnahme, Entlassungsdaten, Aufnahme auf die Intensivstation (ICU), Notwendigkeit mechanischer Beatmung und Art der Entlassung (lebend oder tot) für 5.229 aufeinanderfolgende Patienten, die wegen COVID-19 in sechs europäischen Krankenhäusern und 13 Krankenhäusern in der Provinz Zhejiang, China seit Beginn der Pandemie hospitalisiert wurden (Tabelle 1). Wir schlossen Patienten mit bestätigter Diagnose von COVID-19 zum Zeitpunkt der Aufnahme ein. Wir bestätigten, dass die Patienten ein positives Ergebnis beim Polymerase-Kettenreaktionstest einer nasopharyngealen Probe und/oder eine klinische/radiologische Diagnose von COVID-19 erzielten. Die Patienten wurden nach der Entlassung nicht weiter verfolgt, aber COVID-19-bedingte frühe Wiederaufnahmen wurden als Teil des COVID-19-Verlaufs berücksichtigt. Das Studienprotokoll entsprach den ethischen Richtlinien der Deklaration von Helsinki von 1975. In den Krankenhäusern in Zhejiang, im ASST Papa Giovanni XXIII Hospital in Bergamo, im Hospital del Mar in Barcelona und im Universitätsklinikum Helsinki genehmigten die lokalen Ethikkommissionen diese retrospektive Studie mit COVID-19-Patientendaten. Für das REGIOMED Klinikum Coburg hat die Ethikkommission der Bayerischen Landesärztekammer die Studie genehmigt. Im Verbund des Universitätskrankenhauses Nottingham, im ASST GOM Niguarda, Warschau und Zagreb wurden diese Informationen als öffentliche statistische Informationen veröffentlicht.
Tabelle 1: Grundlegende Informationen über einbezogene Patienten.
| Name der Kohorte | Name des Krankenhauses | Gesamtzahl der Patienten | In die Studie eingeschlossen | Geschlecht (w/m) | Alter (Durchschnitt/Bereich) |
|---|---|---|---|---|---|
| Barcelona | Hospital del Mar | 1.999 | 1.786 | 969/817 | 57 (17 – 101) |
| Bergamo | Krankenhaus ASST Papa Giovanni XXIII | 2.249 | 995 | 265/730 | 70 (6 – 95) |
| Coburg | REGIOMED | 89 | 89 | 48/41 | 75 (18 – 98) |
| Helsinki | 100 | 100 | 44/56 | 54,5 (16 – 84) | |
| Milan | Asst GOM Niguarda | 713 | 685 | 242/443 | 63 (0 – 96) |
| Nottingham | Universitätskliniken Nottingham | 795 | 795 | 356/439 | 75 (0 – 102) |
| Warschau | Zentrales klinisches Krankenhaus des Ministeriums für Inneres und Verwaltung | 122 | 122 | 45/77 | 69 (19 – 96) |
| Zagreb | Klinisches Krankenhaus Dubrava und Universitätsklinik für Infektionskrankheiten | 237 | 237 | 93/144 | 63 (22 – 99) |
| Zhejiang | 610 | 608 | 297/311 | 49 (18 – 93) |
App COVID Symptom Study
Die App COVID-Symptom Study (12) wurde von Zoe mit wissenschaftlichem Input von Forschern und Medizinern des King's College London und des Massachusetts General Hospital entwickelt (https://covid. joinzoe.com/). Sie wurde am 24. März 2020 in Großbritannien eingeführt und erreichte innerhalb von 3 Monaten mehr als 3,9 Millionen Abonnenten. Sie ermöglicht die Erfassung von Selbstauskünften zu COVID-19-Infektionen, wie oben berichtet (12). Wichtig ist, dass Teilnehmer, die in laufenden epidemiologischen Studien, klinischen Kohorten oder klinischen Studien eingeschrieben sind, eine informierte Zustimmung zur Verknüpfung von Daten, die über die App in Übereinstimmung mit HIPAA und der DSGVO gesammelt wurden, mit bestehenden Studiendaten, die sie zuvor bereitgestellt haben oder in Zukunft bereitstellen könnten, erteilen können. Der Verhaltenskodex für die App wurde von der Ethikkommission des King's College London genehmigt (REMAS ID 18210, Review-Referenz LRS-19/20-18210) und alle Nutzer gaben ihr Einverständnis zur nicht-kommerziellen Nutzung. Für diese Arbeit bezogen wir Teilnehmer aus Großbritannien ein, die mit einem gesunden Zustand begannen und später Symptome entwickelten, die in Anlehnung an den in Menni et al. vorgestellten Krankheitsscore zu einem Verdacht auf COVID-19 führten. (12). Um eine Schätzung der Krankheitsdauer zu erhalten, entsprach der Zeitpunkt für das Krankheitsende entweder dem letzten Berichtstag vor Beendigung der Nutzung der App oder dem ersten gesunden Tag, wenn danach sechs aufeinanderfolgende gesunde Tagen gemeldet wurden. Um eine Zensierung zu vermeiden, wurden nur Teilnehmer mit einer Krankheitsdauer von <30 Tagen und mit mit einem Krankheitsbeginn vor dem 17. Mai in die Analyse einbezogen (37.187 Personen). Der Schweregrad wurde als gewichteter Durchschnitt der Symptome zum Zeitpunkt des Krankheitshöhepunkts berechnet, wobei als Gewichtung das normalisierte Verhältnis der Symptomhäufigkeit zum Zeitpunkt des Krankheitshöhepunkts der Personen, die einen Krankenhausbesuch nach Krankheitsbeginn angaben, und denen, die dies nicht taten, verwendet wurde.
Daten in Bezug auf saisonale Änderungen
Die Daten zur Umgebungstemperatur wurden von Climate Data Online [Datenbank der National Centers for Environmental Information (NCEI)] bezogen https://www.ncdc.noaa.gov/cdo-web/.
Statistische Methoden
Die gesammelten Daten aus sieben Kohorten sind in Tabelle 1 zusammengefasst. Patienten ohne Angaben zum Ergebnis wurden aus der Analyse ausgeschlossen. Mittels logistischer Regression wurde der Einfluss des Aufnahmedatums und der lokalen Umgebungstemperatur auf die Veränderung der Sterblichkeit geschätzt.
Die folgenden Patientenmerkmale und Krankenhausaufenthalts-Kovariaten wurden untersucht: Das Ergebnis Gestorben/Entlassen wurde als abhängige Variable und die Aufnahme als unabhängige Variable zusammen mit Alter (in Jahren) und Geschlecht (weiblich/männlich) verwendet. Wir haben dann den gleichen Ansatz für die Abschätzung der Auswirkung der Umgebungstemperatur auf die Notwendigkeit der Aufnahme auf die Intensivstation und für die mechanische Beatmungstherapie verwendet. Ein lineares Modell wurde dann verwendet, um den Effekt der Umgebungstemperatur auf die Krankenhausaufenthaltsdauer (in Tagen) als abhängige Variable und das Aufnahmedatum als unabhängige Variable zusammen mit Alter und Geschlecht zu schätzen. Vor der Analyse wurde eine Datentransformation vorgenommen, bei der die Krankenhausverweildauer um 1 erhöht (aufgrund von Nullen) und log10-transformiert wurde (null Tage Krankenhausverweildauer entsprechen einem Krankenhausaufenthalt mit einer Länge von weniger als 24 h). Eine lineare Regression mit der durchschnittlichen Dauer als abhängige Variable und dem 2-Wochen-Zeitraum als unabhängige Variable wurde angepasst, um die Veränderung im Laufe der Zeit zu bewerten. Für jede abhängige Variable wurden die Rohdaten mit Balkendiagrammen (Tod, Intensivstation und mechanische Beatmung) oder Box- und Whisker-Diagrammen (Krankenhausverweildauer) für Patienten in 2-Wochen-Gruppen dargestellt. Die Füllung der Balken und Kästchen spiegelt die Anzahl der Patienten wider, die in einer bestimmten 2-Wochen-Gruppe ins Krankenhaus eingeliefert wurden. Bei Gruppen mit weniger als fünf Patienten wurden einzelne Datenpunkte aufgezeichnet. Die in den logistischen Regressionen und der linearen Regression geschätzten Koeffizienten wurden mit Hilfe einer inversen varianzgewichteten Meta-Analyse kombiniert, wobei angesichts der Heterogenität der Kohorten Modelle mit zufälligen Effekten verwendet wurden (R-Paket "metaphor"). Die Ergebnisse der Meta-Analyse wurden als Forest Plots dargestellt, die mit dem R-Paket "ggplot2" erstellt wurden. Alle statistischen Analysen wurden in der Programmiersoftware R (Version 3.6.3) durchgeführt, mit Ausnahme der logistischen und linearen Regressionen für die Daten der Milano-Kohorte, die in der Statistiksoftware Stata (Version 12) durchgeführt wurden, und der COVID-Kohorte der Symptom Study, für die die lineare Regression mit dem Python-Paket statsmodels (Version 0.11.1) durchgeführt wurde.
Ergebnisse
Mit dem Ziel, den saisonalen Charakter von COVID-19 zu bewerten, haben wir den Krankheitsverlauf bei 6.914 Personen aus neun Kohorten, die in Krankenhäusern in Europa und China aufgenommen wurden, ausgewertet (Tabelle 1).
Um Stichprobenverzerrungen zu vermeiden, wurden alle Krankenhausaufenthalte, die entweder zum Tod oder zur ärztlichen Entlassung führten, in die Analyse einbezogen. Die tatsächliche Anzahl der Patienten, die gestorben sind, und der Patienten, die sich seit Beginn der Epidemie bis zum letzten Nachverfolgungsdatum, an dem eine zuverlässige Datenerfassung mit Angabe des endgültigen Ergebnisses verfügbar war, erholt haben (gruppiert in 2-Wochen-Intervallen), ist in Abbildung 1A für jedes der Krankenhäuser dargestellt. Die Meta-Analyse der Auswirkung des Aufnahmedatums auf die Sterblichkeitsquote ist in Abbildung 1B dargestellt. Die signifikanteste Veränderung wurde in Barcelona beobachtet, wo die Sterblichkeitswahrscheinlichkeit um 4,1 % pro Tag sank (p < 0,001). Der gewichtete durchschnittliche Rückgang der Sterblichkeitsquote über alle untersuchten Krankenhäuser hinweg betrug 1,9 % pro Tag (p < 0,001). Unser Modell beinhaltete das Alter als Kovariate, daher ist es unwahrscheinlich, dass diese Veränderung durch die Veränderung des Alters der Patienten erklärt werden kann. Um darüber hinaus zu bestätigen, dass das Alter nicht den beobachteten Veränderungen zugrunde lag, analysierten wir das Alter der Patienten, die in verschiedenen Zeiträumen in Krankenhäusern aufgenommen wurden, und wiesen nach, dass die Veränderung des Alters der Patienten kein Faktor war, der den beobachteten Rückgang der Sterblichkeit erklären konnte (Ergänzende Abbildung 1).
Da es kein einheitliches Maß oder eine einheitliche Klassifizierung des COVID-19-Schweregrads gibt, das/die in allen Krankenhäusern verwendet wird, haben wir zur weiteren Bewertung des Krankheitsschweregrads sekundäre Endpunkte analysiert. Wir verglichen die Dauer des Krankenhausaufenthalts, die Notwendigkeit der Intensivstation und separat die mechanische Beatmung. Ein starker und statistisch signifikanter Rückgang der Dauer des Krankenhausaufenthalts wurde in Barcelona, Coburg, Mailand, Nottingham und Zagreb beobachtet. In Helsinki, Warschau und Zhejiang ging die Veränderung in die gleiche Richtung, war aber statistisch nicht signifikant. Der einzige Ausreißer war Bergamo, wo die Veränderung in die entgegengesetzte Richtung ging, jedoch statistisch nicht signifikant war (Ergänzende Abbildung 2). In der Meta-Analyse war der Rückgang der Hospitalisierungsdauer statistisch signifikant (10b = 0,995; CI = 0,991–0,998; p = 0,007). Die Quote für den Bedarf an Intensivpflege sank in allen Krankenhäusern in Europa und war individuell statistisch signifikant in allen Krankenhäusern außer Bergamo, Helsinki und Zagreb (Ergänzende Abbildung 3). Die Meta-Analyse der europäischen Krankenhäuser ging davon aus, dass die Wahrscheinlichkeit, die Intensivstation zu benötigen, um 2,2 % pro Tag der Änderung des Aufnahmedatums abnahm (OR = 0,978; CI = 0,962 – 0,993; p = 0,008) und die Wahrscheinlichkeit, mechanische Beatmung zu benötigen, sank um 2,1 % (OR = 0,979; CI = 0,964 – 0,994; p = 0,008) pro Tag der Änderung des Aufnahmedatums (Ergänzende Abbildung 4).
Während alle Krankenhäuser in Europa im Grunde den gleichen Trend eines mit der Zeit abnehmenden COVID-19-Schweregrads aufwiesen, gab es in den Krankenhäusern in Zhejiang entweder keine Veränderung oder die Veränderungen verliefen nicht-signifikant in die entgegengesetzte Richtung zu den europäischen Einrichtungen. Der bemerkenswerteste Unterschied zwischen der COVID-19-Pandemie in Europa und der in China war, dass die Epidemie in China ausschließlich im Winter stattfand, während sie in Europa sowohl den Winter als auch den Frühling umfasste. Um festzustellen, ob das Wetter ein wichtiger Faktor war, korrelierten wir die beobachteten Änderungen mit der lokalen Umgebungstemperatur. Die niedrigsten und höchsten lokalen Temperaturen für alle Krankenhäuser sind in der ergänzenden Abbildung 5 dargestellt. Um zu beurteilen, ob die Temperaturänderung für die beobachteten Veränderungen der Krankheitsschwere verantwortlich sein könnte, modellierten wir die Sterblichkeit mit der Umgebungstemperatur anstelle des Aufnahmedatums.
Die in Abbildung 2 dargestellten Ergebnisse deuten auf eine starke Auswirkung der Umgebungstemperatur auf das Sterberisiko hin (OR = 0,854 pro 1◦C; CI = 0,773 – 0,944; p = 0,007). Um die Veränderung von COVID-19 mit der Zeit weiter zu verifizieren, analysierten wir individuelle Symptomdaten für 37.187 Teilnehmer der App Symptom Study für COVID. Obwohl es auch in dieser Studie eine Stichprobenverzerrung gibt, unterscheidet sie sich von der Verzerrung für den Krankenhausaufenthalt, so dass es beruhigend war, eine allmähliche Abnahme der Dauer der Symptome und des COVID-19-Schweregrads im April und Mai zu beobachten (Abbildung 3). Eine Auswertung des Gefälles der Dauer als Funktion der Zeit (2 ISO-Wochen) zeigte eine signifikante Abnahme der Dauer (B = - 0,7 p = 0,006). Bezüglich des Schweregrades war die Tendenz zur Abnahme zwar nicht nicht signifikant (– 0,0014 p = 0,836), aber der Trend zur Abnahme war stärker, wenn man den letzten Zeitraum betrachtet (Punkt 1 bis zum Ende des Gefälles = – 0,0112 p = 0,116).
Diskussion
Durch die Analyse von Krankenhausakten von 6.914 Patienten, die in acht europäischen Krankenhäusern aufgenommen wurden, beobachteten wir mit der Zeit eine starke und statistisch signifikante Abnahme der COVID 19-Sterblichkeit und des Schweregrads. Eine mögliche Veränderung des Durchschnittsalters der Patienten in den verschiedenen Stadien der Pandemie ist die erste offensichtliche Erklärung für den verringerten Schweregrad, da das Alter der stärkste Indiktator für den Schweregrad von COVID- 19 ist [mit einem bis zu 100-fachen Unterschied im Sterberisiko (13)]. Allerdings war das Alter in unserem Modell als Kovariate enthalten und außerdem änderte sich das Durchschnittsalter der Patienten im Laufe der Zeit nicht (Ergänzende Abbildung 2), so dass wir diese Hypothese ausgeschlossen haben. Eine andere Erklärung könnte sein, dass sich die Richtlinien für die Aufnahme und/oder Entlassung von COVID-19-Patienten während des ausgewerteten Zeitraums geändert haben - möglicherweise aufgrund einer "Überlastung" der medizinischen Einrichtungen. Dies könnte besonders in der Situation begrenzter Krankenhauskapazitäten relevant gewesen sein, wenn der Krankenhauseinweisung eine Triage vorausging, um Patienten zu identifizieren, die von einer Krankenhauseinweisung, Aufnahme auf der Intensivstation oder mechanischer Beatmung profitieren könnten. Allerdings war Bergamo das einzige Krankenhaus in unserer Kohorte, das die volle Kapazität erreichte, während alle anderen weit unter der maximalen Kapazität für den Krankenhausaufenthalt oder die Intensivstation arbeiteten, was darauf hindeutet, dass Änderungen in der Krankenhausaufnahmepolitik nicht der Hauptgrund für die beobachtete Veränderung der Sterblichkeit und des Schweregrads von COVID–19 waren. Diese Schlussfolgerung wird auch durch die gleichzeitige Abnahme der Dauer und des Schweregrads der Symptome bei nicht-hospitalisierten Personen, die Symptome in der COVID-App Symptom-Study meldeten, unterstützt (Abbildung 3). Eine Änderung des COVID-19-Managements könnte ebenfalls zu einem geringeren Schweregrad geführt haben. Alle diese Änderungen waren jedoch krankenhausspezifisch, und im analysierten Zeitraum war die effektivste Verbesserung der Therapie die Einführung von Dexamethason, das die Sterblichkeit von 24,6 auf 21,6 % senkte (14). Da wir immer mehr über COVID-19 lernen, werden die Patienten immer besser behandelt, aber der Fortschritt war bisher nicht allzu groß, was besonders an der erhöhten Sterblichkeit in der zweiten Welle in Australien zu erkennen ist [die Fallsterblichkeitsrate (CFR) lag in der ersten Welle bei 0,5 % (15) und in der zweiten Welle bei 3,1 % (16)]. Daher ist es schwer vorstellbar, dass geringfügige Änderungen im Patientenmanagement wesentlich zu dem beobachteten Rückgang der Sterblichkeit und des Schweregrads der Erkrankung in Europa beigetragen haben könnten.
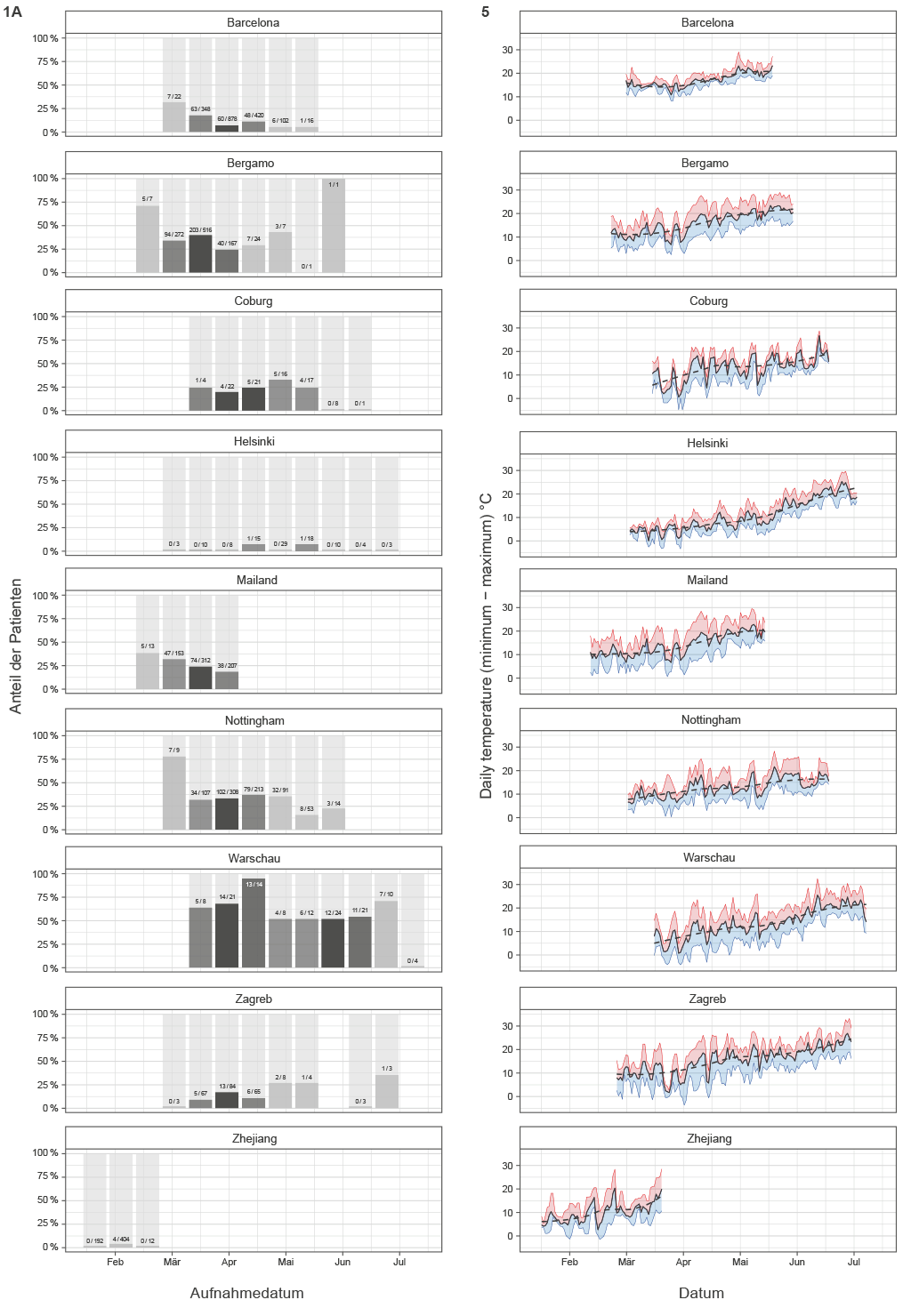
ABBILDUNG 1 A | Sterblichkeit bei Personen, die mit COVID-19 in Krankenhäuser eingeliefert wurden. (A) Krankenhausaufenthaltsergebnis (Tod/Entlassung) in Abhängigkeit vom Aufnahmedatum (gruppiert in 2-Wochen-Intervallen) seit dem Beginn der Pandemie.
ERGÄNZENDE ABBILDUNG 5 | Tägliche Umgebungstemperaturen im Untersuchungszeitraum. Durchgezogene schwarze Linie – durchschnittliche Tagestemperatur, rote Linie – Tagesmaximum, blaue Linie – Tagesminimum. Gestrichelt schwarze Linie – lokal geschätzte Streudiagrammglättung der täglichen Durchschnittstemperatur. Daten wurden von Climate Data Online (National Centers for Environmental Informationsdatenbank (NCEI): https://www.ncdc.noaa.gov/cdo-web/
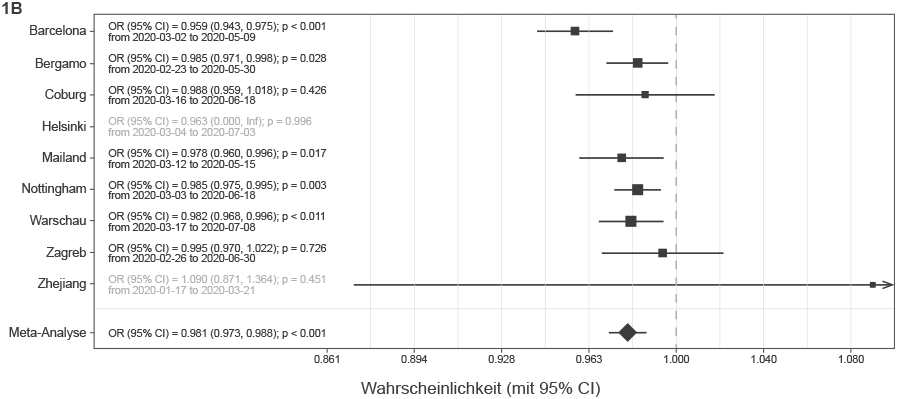
ABBILDUNG 1 B | Sterblichkeit bei Personen, die mit COVID-19 in Krankenhäuser eingeliefert wurden. (B) Meta-Analyse der Auswirkungen des Aufnahmedatums auf die Sterblichkeit (dargestellt als Chancenverhältnis pro 1-Tageszunahme des Aufnahmedatums). In Helsinki gab es nur zwei Todesfälle und in den Krankenhäusern in Zhejiang vier Todesfälle, so dass sie nicht in die Meta-Analyse einbezogen wurden. OR, Chancenverhältnis; CI, Konfidenzintervall.
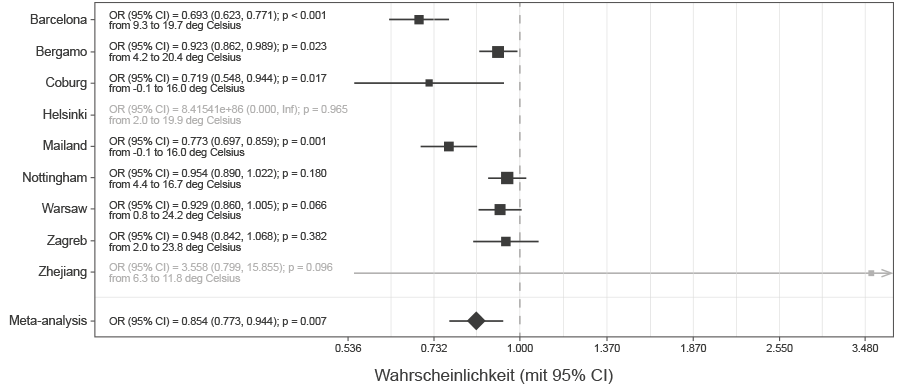
ABBILDUNG 2 | Meta-Analyse der Auswirkungen der Temperatur auf die Sterblichkeit (dargestellt als Chancenverhältnis pro 1◦C Anstieg der durchschnittlichen Tagestemperatur während des Krankenhausaufenthalts). In Helsinki gab es nur zwei Todesfälle und in den Krankenhäusern in Zhejiang vier Todesfälle, so dass sie nicht in die Meta-Analyse einbezogen wurden. OR, Chancenverhältnis; CI, Konfidenzintervall.
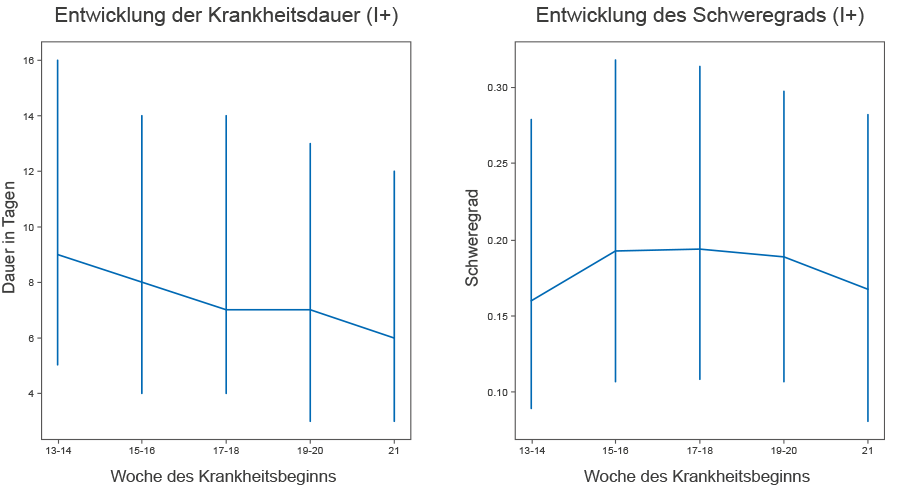
ABBILDUNG 3 | Daten von 37.187 Personen/verdächtigten COVID-Positiven (I+), die Symptome in der App COVID Symptom Study in Großbritannien aufzeichneten, deuten darauf hin, dass sowohl der Schweregrad (gemessen als gewichtete Summe der Symptome unter Berücksichtigung des Unterschieds zum Krankheitshöhepunkt zwischen denjenigen, die einen Krankenhausbesuch melden, und denjenigen, die dies nicht tun) als auch die Dauer der Krankheitssymptome in Großbritannien leicht abnehmen (Durchschnittswerte und Quartilsabstände sind dargestellt). Der kalkulatorische Status definiert gemäß der Anwendung des von Menni et al. beschriebenen Vorhersagemodells (12) wurde gegenüber der definitiven PCR-Diagnostik gewählt, um den Störfaktor der Änderungen der Testzugangsregeln zu vermeiden.
Nach Ausschluss dieser drei Ursachen für eine europaweite Abnahme des Schweregrads und der Sterblichkeit der Krankheit im Zeitraum von März bis Juni, stellte sich der Wechsel der Jahreszeit als wahrscheinlichste Erklärung heraus, da die Umgebungstemperatur an allen untersuchten Standorten in diesem Zeitraum deutlich anstieg (Ergänzende Abbildung 5). Der Austausch des Krankenhausaufnahme-Datums mit der lokalen Temperatur (Abbildung 2) zeigte, dass die Temperatur stark mit der Abnahme der COVID-19-Sterblichkeit korrelierte. Da eine umgekehrte Verursachung nicht möglich ist, kann man davon ausgehen, dass COVID-19 als Krankheit einen starken saisonalen Charakter hat.
Trotz der Tatsache, dass die meisten humanen Coronaviren stark saisonabhängig sind (17), wird der saisonale Charakter von COVID-19 häufig mit der Tatsache in Frage gestellt, dass zahlreiche Fälle in tropischen Ländern gemeldet wurden und das Virus offensichtlich auch in heißen und feuchten Klimagebieten effizient übertragen werden kann.
In all diesen Ländern sind jedoch die Sterblichkeit und der Schweregrad der Erkrankung sehr gering (z. B. meldete Singapur 26 Todesfälle und über 44.000 bestätigte Infektionen), was eigentlich darauf hindeutet, dass es saisonale oder klimatisch bedingte Unterschiede des Schweregrads von COVID-19 geben könnte. Es ist möglich, dass dies auch bei anderen Atemwegsviren der Fall ist, die eine starke Saisonabhängigkeit aufweisen, aber asymptomatische Personen werden im Allgemeinen nicht auf das Vorhandensein von viraler RNA in der Nase getestet; daher wurde eine virale Übertragung außerhalb ihrer Saison nicht beobachtet. Die bemerkenswerte Ausnahme, die diese Hypothese bestätigt, war die Schweinegrippe-Pandemie 2009 in England, als auch im Sommer zahlreiche PCR-Tests durchgeführt wurden. Diese Tests ergaben eine Infektion bei über 250.000 Menschen in der Sommerwelle, jedoch mit einer viel geringeren Sterblichkeit als in der schwachen Welle (18). Der starke Anstieg der Anzahl von Personen mit positiven PCR-Tests für SARS-CoV-2 in Europa im Spätsommer und Frühherbst 2020 geht nicht mit einem entsprechenden Anstieg der Todesfälle einher. Der Anstieg der Fallzahlen und die Veränderung in der Altersverteilung der Patienten (19) wurden als mögliche Erklärung für die fehlenden Todesfälle vorgeschlagen. In Australien, wo die Jahreszeiten umgekehrt sind, war die Situation jedoch genau umgekehrt, und die Sterblichkeit war in der zweiten (Winter-)Welle der Pandemie viel höher. Trotz vermehrter Tests und einer globalen Zunahme des Wissens über die Behandlung von Patienten war die CFR in der zweiten (Winter-)Welle sechsmal höher als in der ersten (Sommer-)Welle [die "Winter"-Letalität lag bei 3,1 % (16) im Vergleich zur "Sommer"-Letalität, die nur 0,5 % betrug (15)].
Es ist sehr schwierig, die Kausalität in einer Beobachtungsstudie nachzuweisen, insbesondere wenn viele korrelierende Faktoren gleichzeitig verändert werden, aber die beobachtete Abnahme des COVID-19-Schweregrads mit dem Ende des Winters passt sehr gut zu den bekannten Auswirkungen der Außentemperatur auf die Luftfeuchtigkeit in Innenräumen und der daraus resultierenden Wiederherstellung der Barrierefunktion der Schleimhäute, die während der Heizperiode oft durch trockene Luft beeinträchtigt wird (20). Die meisten Atemwegsviren erreichen ihren Höhepunkt im Winter, und die Schwankungen von Temperatur und Luftfeuchtigkeit wurden als die stärksten Treiber der Saisonabhängigkeit angegeben, insbesondere im Zusammenhang mit der Epidemie in der Wintersaison (17). Der Höhepunkt der Infektion und der Schweregrad der Erkrankung sind jedoch nicht immer vollständig aufeinander abgestimmt. Obwohl zum Beispiel die Infektionsraten von Rhinoviren im Frühjahr und Herbst ihren Höhepunkt erreichen, nimmt die Krankheitsschwere im Winter zu (21). Das saisonale Auftreten von Atemwegsviren wird häufig auf die saisonale Überbelegung von Innenräumen und die Auswirkungen von Temperatur und Luftfeuchtigkeit auf die Stabilität der Viruspartikel zurückgeführt (22), wobei die Wirkung einer niedrigen Luftfeuchtigkeit auf die Schleimhautbarriere oft vernachlässigt wird. Obwohl Schleim oft als physikalische Barriere betrachtet wird, ist er in Wirklichkeit eine aktive biologische Barriere, die Viren und Bakterien mit Muzinen vernetzt, einer Gruppe hochglykosylierter Proteine, die an unsere Schleimhautbarrieren sezerniert werden, wo sie sich selbst zu langen Polymeren zusammenfügen (23). Muzinglykane imitieren die Zelloberflächenglykosylierung und fangen als Köder für virale Lektine virale Partikel ab, die dann durch die mukoziliäre Freigabe aus den Atemwegen transportiert werden (24). Da alle behüllten Viren hochgradig glykosyliert sind, werden außerdem eine Reihe von Lektinen wie Trefoil-Faktoren (TFF) in die Schleimhäute sezerniert, wo sie die Viren durch Bindung an Glykane sowohl auf den Viren als auch auf den Muzinen vernetzen (25). Diese Barriere ist jedoch nur dann funktionsfähig, wenn sie gut hydriert ist, um sowohl ihre strukturelle Integrität zu erhalten als auch einen konstanten Schleimfluss zu ermöglichen, der Viren und andere Krankheitserreger aus unseren Atemwegen entfernt (24).
Wenn sie trockener Luft ausgesetzt sind, trocknen diese Barrieren aus und können ihre Schutzfunktionen nicht mehr erfüllen (26). Tierversuche zeigten die Bedeutung der Luftfeuchtigkeit sowohl für die Transfektion von Atemwegsviren als auch für die Schwere der Erkrankung (27–29), während Studien auf Bevölkerungsebene in den USA auf die Bedeutung der Luftfeuchtigkeit für die Influenzaübertragung hinwiesen (30). Eine dieser Studien zeigte, dass eine Erhöhung der relativen Luftfeuchtigkeit von 20 auf 50 % die Sterblichkeit bei Influenza-Infektionen signifikant senken kann (29). In einer anderen Studie reduzierte die Luftbefeuchtung bei Patienten mit obstruktiver Schlafapnoe die nasalen Symptome um 60 % (31), was alles darauf hindeutet, dass die schützende Wirkung der Luftfeuchtigkeit auf die Schleimhautbarriere ein dominanter molekularer Mechanismus hinter der Saisonabhängigkeit von Atemwegsviren sein könnte.
Ein großer Teil der interindividuellen Unterschiede bei Menschen basiert auf Glykanen, und die Glykan-Diversität stellt einen der Hauptabwehrmechanismen aller höheren Organismen gegen Pathogene dar (32). Glykane (die kovalent an die meisten Proteine gebunden sind) sind chemische Strukturen, die als komplexe Merkmale vererbt werden, was Diversität und signifikante interindividuelle Unterschiede ermöglicht (33). Das SARS-CoV-2-Spike-Glykoprotein ist stark glykosyliert (34), und es wurde berichtet, dass es sich mit Glykosaminoglykanen (35) und sialylierten Glykanen verknüpft (36). ABO-Blutgruppenantigene sind ebenfalls Glykane und sind wahrscheinlich das bekannteste Beispiel für Glykan-Diversität; interessanterweise sind Menschen mit Blutgruppe A und damit mit einem N-Acetylgalaktosamin anfälliger für COVID-19 als der Typ O (37). All dies deutet darauf hin, dass auch SARS-CoV-2, wie die meisten anderen Viren, für die Übertragung auf Glykane angewiesen ist, was die Bedeutung von Muzinen und einer funktionellen Schleimhautbarriere bei COVID-19 weiter unterstützt.
Die mukoziliäre Dysfunktion und die Beeinträchtigung der Atemwegsbarriere begünstigen sowohl die Erstinfektion als auch die Ausbreitung der Viren in den Atemwegen einer infizierten Person (29). Die Inhalation von trockener Luft verringert die nasale mukoziliäre Übergangszeit (NMTT) bei gesunden Personen (38) erheblich, was die Dauer der Virusexposition auf der Nasenschleimhaut beeinflusst. Nasale Epithelzellen sind das Hauptportal für die Erstinfektion und die Übertragung von SARS-CoV-2 (39). Patienten, die eine klinisch relevante Infektion nach experimenteller transnasaler viraler Herausforderung (Rhinovirus oder Infl. B) entwickelten, wiesen eine reduzierte epitheliale Barrierefunktion (erhöhter transepithelialer Widerstand, reduzierte Anzahl von Flimmerzellen und erhöhte NMTT im Vergleich zu denen auf, die nicht infiziert waren oder eine milde Form erlitten) (40). Eine experimentelle In vitro-Virusinfektion führte jedoch nur zu einer verminderten Anzahl von Flimmerzellen, ohne die Tight-Junction-Proteinexpression zu beeinflussen (41). Diese Kontroverse zwischen In vivo- und In vitro-Experimenten deutet auf die Bedeutung der Immunantwort bei der Kontrolle der epithelialen Barrierefunktion hin (42). Neuere Studien über die Wechselwirkung zwischen Klimaveränderungen und der Dysfunktion der Atemwegsbarriere wiesen nicht nur auf eine höhere Inzidenz von Virusinfektionen hin, sondern auch auf eine höhere Anfälligkeit der Nasenschleimhaut durch eine erhöhte Inzidenz von Nasenbluten in den Notaufnahmen unter den Bedingungen niedriger Temperatur und niedriger Luftfeuchtigkeit (43). Eine kürzlich veröffentlichte Studie, in der Probanden dem Respiratorischen Synzytialvirus (RSV), einem der Erreger der Erkältung, ausgesetzt wurden, zeigte, dass eine bereits bestehende Entzündung der Atemwegsschleimhaut ein Risikofaktor für die Infektion war (44), was die Bedeutung der mukoziliären Dysfunktion und der Beeinträchtigung der respiratorischen Barriere für die Infektion mit respiratorischen Viren weiter unterstützt.
Einschränkungen
Eine mögliche Verzerrung der Stichprobe ist die hauptsächliche Einschränkung dieser Studie. Durch die Fokussierung auf den individuellen Krankheitsverlauf bei bereits hospitalisierten Patienten schlossen wir die Auswirkungen der unbekannten Anzahl echter Infektionen auf die nationale Sterblichkeitsrate aus. Dennoch können wir die Möglichkeit nicht ausschließen, dass einige andere, nicht identifizierte externe Faktoren (einschließlich Ausgangssperre und sozialer Distanzierung, Verbesserung und Einhaltung von Präventions- und Umwelthygieneprotokollen und sogar verringerte Luftverschmutzung, die den Schweregrad der im Krankenhaus ankommenden Patienten progressiv beeinflusst haben könnten) die Zusammensetzung der hospitalisierten Patientenkohorten beeinflussten und zu einem verringerten COVID-19-Schweregrad und geringerer Sterblichkeit beitrugen. Daher ist es wichtig, dass die Nachverfolgung der individuellen Symptome bei 37.187 britischen Patienten den gleichen Trend zeigt, da es sich um Personen handelt, die ihre Symptome freiwillig angeben und eine mögliche Stichprobenverzerrung unabhängig von der Verzerrung bei der Krankenhauseinweisung ist. Die Entscheidung, kalkulatorische Positive einzubeziehen, war hauptsächlich durch die Beschränkung des Testzugangs motiviert, die in der ersten Welle beobachtet wurde, bevor sie im Mai und Juni gelockert wurde. Die ausschließliche Berücksichtigung von PCR-getesteten positiven Meldungen an die App hätte die Ergebnisse in den ersten Tagen unangemessen in Richtung eines höheren Schweregrads verzerrt. Wir haben stattdessen das Modell von Menni et al. übernommen, (12), das eine angemessene Leistung bei der Vorhersage positiver Fälle erzielte (ROC-AUC 76 %).
Schlussfolgerungen
Unsere Daten deuten darauf hin, dass neben dem Einfluss auf die Virusübertragung auch Umweltfaktoren bei bereits infizierten Patienten eine wichtige Rolle spielen. Der Schweregrad von COVID-19 nahm mit dem Einsetzen des Frühlings ab, was ein düsteres Bild für den kommenden Winter zeichnet und darauf hindeutet, dass sowohl der Schweregrad der Krankheit als auch die Sterblichkeit deutlich zunehmen könnten. Da in vielen Krankenhäusern im Winter sehr trockene Luft herrscht, kann es von Vorteil sein, Patienten in frühen Krankheitsstadien befeuchtete Luft zur Verfügung zu stellen. In Anbetracht der offensichtlich schädlichen Wirkung von trockener Luft auf unsere Schleimhautbarriere und deren Rolle als erste Verteidigungslinie gegen Infektionen (45), wäre es in der Situation der schnell fortschreitenden COVID-19-Pandemie unerlässlich, eine universelle Befeuchtung der trockenen Luft in allen öffentlichen und privaten beheizten Räumen sowie eine aktive Nasenhygiene und Flüssigkeitszufuhr aktiv zu fördern (46). Die Luftfeuchtigkeit sollte auch in gekühlten Gebäuden mit eingeschränktem Zugang zur Außenluft überwacht werden, da die Klimaanlage auch eine effektive Entfeuchtung darstellt und zu sehr trockener Luft führen kann.
Datenverfügbarkeitserklärung
Die Rohdaten, die die Schlussfolgerungen dieses Artikels unterstützen, werden von den Autoren ohne Vorbehalt zur Verfügung gestellt.
Quellen
Originaltitel: Effects of Environmental Factors on Severity and Mortality of COVID-19
Autoren: Domagoj Kifer, Dario Bugada, Judit Villar-Garcia, Ivan Gudelj, Cristina Menni, Carole Sudre, Frano Vuckovic, Ivo Ugrina, Luca F. Lorini, Margarita Posso, Silvia Bettinelli, Nicola Ughi, Alessandro Maloberti, Oscar Epis, Cristina Giannattasio, Claudio Rossetti, Livije Kalogjera, Jasminka Peršec, Luke Ollivere, Benjamin J. Ollivere, Huadong Yan, Ting Cai, Guruprasad P. Aithal, Claire J. Steves, Anu Kantele, Mikael Kajova, Olli Vapalahti, Antti Sajantila, Rafal Wojtowicz, Waldemar Wierzba, Zbigniew Krol, Artur Zaczynski, Katarina Zycinska, Marek Postula, Ivica Lukšic, Rok Civljak, Alemka Markotic, Johannes Brachmann, Andreas Markl, Christian Mahnkopf, Benjamin Murray, Sebastien Ourselin, Ana M. Valdes, Juan P. Horcajada, Xavier Castells, Julio Pascual, Massimo Allegri, Dragan Primorac, Tim D. Spector, Clara Barrios and Gordan Lauc
Quellenlink: https://doi.org/10.3389/fmed.2020.607786
Veröffentlicht: Januar 2021
1. Oran DP, Topol EJ. Prevalence of asymptomatic SARS-CoV-2 infection. Ann Intern Med. (2020) 173: 362–7. doi: 10.7326/M20-3012
2. Qi H, Xiao S, Shi R, Ward MP, Chen Y, Tu W, et al. COVID- 19 transmission in Mainland China is associated with temperature and humidity: a time-series analysis. Sci Total Environ. (2020) 728:138778. doi: 10.1016/j.scitotenv.2020.138778
3. Sahin M. Impact of weather on COVID-19 pandemic in Turkey. Sci Total Environ. (2020) 728:138810. doi: 10.1016/j.scitotenv.2020.138810
4. Méndez-Arriaga F. The temperature and regional climate effects on communitarian COVID-19 contagion in Mexico throughout phase 1. Sci Total Environ. (2020) 735:139560. doi: 10.1016/j.scitotenv.2020. 139560
5. Prata DN, Rodrigues W, Bermejo PH. Temperature significantly changes COVID-19 transmission in (sub)tropical cities of Brazil. Sci Total Environ. (2020) 729:138862. doi: 10.1016/j.scitotenv.2020.138862
6. Sehra ST, Salciccioli JD, Wiebe DJ, Fundin S, Baker JF. Maximum daily temperature, precipitation, ultra-violet light and rates of transmission of SARS-Cov-2 in the United States. Clin Infect Dis. (2020) 71:2482–7. doi: 10.1093/cid/ciaa681
7. Ward MP, Xiao S, Zhang Z. The role of climate during the COVID-19 epidemic in New South Wales, Australia. Transbound Emerg Dis. (2020) 67:2313–7. doi: 10.22541/au.158879258.84484606
8. Briz-Redón Á, Serrano-Aroca Á. A spatio-temporal analysis for exploring the effect of temperature on COVID-19 early evolution in Spain. Sci Total Environ. (2020) 728:138811. doi: 10.1016/j.scitotenv.2020.138811
9. Jahangiri M, Jahangiri M, Najafgholipour M. The sensitivity and specificity analyses of ambient temperature and population size on the transmission rate of the novel coronavirus (COVID-19) in different provinces of Iran. Sci Total Environ. (2020) 728:138872. doi: 10.1016/j.scitotenv.2020.138872
10. Wu Y, Jing W, Liu J, Ma Q, Yuan J, Wang Y, et al. Effects of temperature and humidity on the daily new cases and new deaths of COVID-19 in 166 countries. Sci Total Environ. (2020) 729:139051. doi: 10.1016/j.scitotenv.2020.139051
11. Baker RE, Yang W, Vecchi GA, Metcalf CJE, Grenfell BT. Susceptible supply limits the role of climate in the early SARS-CoV-2 pandemic. Science. (2020) 369:315–9. doi: 10.1126/science.abc2535
12. Menni C, Valdes AM, Freidin MB, Sudre CH, Nguyen LH, Drew DA, et al. Real-time tracking of self-reported symptoms to predict potential COVID-19. Nat Med. (2020) 26:1037–40. doi: 10.1038/s41591-020-0916-2
13. Williamson E, Walker AJ, Bhaskaran KJ, Bacon S, Bates C, Morton CE, et al. OpenSAFELY: factors associated with COVID-19-related hospital death in the linked electronic health records of 17 million adult NHS patients. medRxiv [Preprint]. (2020). doi: 10.1101/2020.05.06.20092999
14. Horby P, Lim WS, Emberson J, Mafham M, Bell J, Linsell L, et al. Effect of dexamethasone in hospitalized patients with COVID-19: preliminary report. medRxiv [Preprint]. (2020). doi: 10.1101/2020.06.22.20137273
15. COVID-19, Australia: epidemiology report 10: reporting week ending 23:59 AEST 5 April 2020. Commun Dis Intell. (2020) 44:1–21. doi: 10.33321/cdi.2020.44.30
16. COVID-19 Australia: epidemiology report 26: fortnightly reporting period ending 27 September 2020. Commun Dis Intell. (2020) 44:1–28. doi: 10.33321/cdi.2020.44.78
17. Moriyama M, Hugentobler WJ, Iwasaki A. Seasonality of respiratory viral infections. Annu Rev Virol. (2020) 7:83–101. doi: 10.1146/annurev-virology-012420-022445
18. Mytton OT, Rutter PD, Mak M, Stanton EAI, Sachedina N, Donaldson LJ. Mortality due to pandemic (H1N1) 2009 influenza in England: a comparison of the first and second waves. Epidemiol Infect. (2012) 140:1533– 41. doi: 10.1017/S0950268811001968
19. Levin AT, Hanage WP, Owusu-Boaitey N, Cochran KB, Walsh SP, Meyerowitz- Katz G. Assessing the age specificity of infection fatality rates for COVID- 19: systematic review, meta-analysis, and public policy implications. medRxiv [Preprint]. (2020). doi: 10.3386/w27597
20. Lauc G, Markotic A, Gornik I, Primorac D. Fighting COVID-19 with water. J Glob Health. (2020) 10:010344. doi: 10.7189/jogh.10.010344
21. Bagheri SHR, Asghari AM, Farhadi M, Shamshiri AR, Kabir A, Kamrava SK, et al. Coincidence of COVID-19 epidemic and olfactory dysfunction outbreak. medRxiv [Preprint]. (2020). doi: 10.1101/2020.03.23.20041889
22. Derby MM, Hamehkasi M, Eckels S, Hwang GM, Jones B, Maghirang R, et al. Update of the scientific evidence for specifying lower limit relative humidity levels for comfort, health, and indoor environmental quality in occupied spaces (RP-1630). Sci Technol Built Environ. (2017) 23:30–45. doi: 10.1080/23744731.2016.1206430
23. Javitt G, Khmelnitsky L, Albert L, Elad N, Ilani T, Diskin R, et al. Assembly mechanism of Mucin and von Willebrand factor polymers. Cell. (2020) 183:717–29.e16. doi: 10.1101/2020.03.08.982447
24. Wheeler KM, Cárcamo-Oyarce G, Turner BS, Dellos-Nolan S, Co JY, Lehoux S, et al. Mucin glycans attenuate the virulence of Pseudomonas aeruginosa in infection. Nat Microbiol. (2019) 4:2146–54. doi: 10.1038/s41564-019-0581-8
25. Järvå MA, Lingford JP, John A, Soler NM, Scott NE, Goddard-Borger ED. Trefoil factors share a lectin activity that defines their role in mucus. Nat Commun. (2020) 11:2265. doi: 10.1038/s41467-020-16223-7
26. Pflüger R, Feist W, Tietjen A, Neher A. Physiological impairments at low indoor air humidity. Gefahrstoffe Reinhaltung der Luft. (2013) 73:107–8.
27. Lowen AC, Steel J. Roles of humidity and temperature in shaping influenza seasonality. J Virol. (2014) 88:7692–5. doi: 10.1128/JVI.03544-13
28. Shaman J, Kohn M. Absolute humidity modulates influenza survival, transmission, and seasonality. Proc Natl Acad Sci USA. (2009) 106:3243–8. doi: 10.1073/pnas.0806852106
29. Kudo E, Song E, Yockey LJ, Rakib T, Wong PW, Homer RJ, et al. Low ambient humidity impairs barrier function and innate resistance against influenza infection. Proc Natl Acad Sci USA. (2019) 166:10905–10. doi: 10.1073/pnas.1902840116
30. Shaman J, Pitzer VE, Viboud C, Grenfell BT, Lipsitch M. Absolute humidity and the seasonal onset of influenza in the continental United States. PLoS Biol. (2010) 8:e1000316. doi: 10.1371/annotation/9ddc5251-72a1-4eba-ae35-9ab04488527b
31. Ryan S, Doherty LS, Nolan GM, McNicholas WT. Effects of heated humidification and topical steroids on compliance, nasal symptoms, and quality of life in patients with obstructive sleep apnea syndrome using nasal continuous positive airway pressure. J Clin Sleep Med. (2009) 5:422–7. doi: 10.5664/jcsm.27596
32. KneŽevic´ A, Polašek O, Gornik O, Rudan I, Campbell H, Hayward C, et al. Variability, heritability and environmental determinants of human plasma n-glycome. J Proteome Res. (2009) 8:694–701. doi: 10.1021/pr800737u
33. Krištic´ J, Zaytseva OO, Ram R, Nguyen Q, Novokmet M, Vucˇkovic´ F, et al. Profiling and genetic control of the murine immunoglobulin G glycome. Nat Chem Biol. (2018) 14:516–24. doi: 10.1038/s41589-018- 0034-3
34. Watanabe Y, Allen JD, Wrapp D, McLellan JS, Crispin M. Site-specific glycan analysis of the SARS-CoV-2 spike. Science. (2020) 9983:eabb9983. doi: 10.1126/science.abb9983
35. Mycroft-West C, Su D, Li Y, Guimond S, Rudd T, Elli S, et al. Glycosaminoglycans induce conformational change in the SARS- CoV-2 spike S1 receptor binding domain. bioRxiv [Preprint]. (2020). doi: 10.1101/2020.04.29.068767
36. Baker AN, Richards S-J, Guy CS, Congdon TR, Hasan M, Zwetsloot AJ, et al. The SARS-COV-2 spike protein binds sialic acids, and enables rapid detection in a lateral flow point of care diagnostic device. ACS Cent Sci. (2020) 6:2046–52. doi: 10.1021/acscentsci.0c00855
37. Zietz M, Tatonetti NP. Testing the association between blood type and COVID-19 infection, intubation, and death. medRxiv [Preprint]. (2020). doi: 10.1101/2020.04.08.20058073
38. Salah B, Dinh Xuan AT, Fouilladieu JL, Lockhart A, Regnard J. Nasal mucociliary transport in healthy subjects is slower when breathing dry air. Eur Respir J. (1988) 1:852–5.
39. Sungnak W, Huang N, Bécavin C, Berg M, Queen R, Litvinukova M, et al. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nat Med. (2020) 26:681–7. doi: 10.1038/s41591-020-0868-6
40. Wilson R, Alton E, Rutman A, Higgins P, Al Nakib W, Geddes DM, et al. Upper respiratory tract viral infection and mucociliary clearance. Eur J Respir Dis. (1987) 70:272–9.
41. Wu NH, Yang W, Beineke A, Dijkman R, Matrosovich M, Baumgärtner W, et al. The differentiated airway epithelium infected by influenza viruses maintains the barrier function despite a dramatic loss of ciliated cells. Sci Rep. (2016) 6:39668. doi: 10.1038/srep39668
42. Short KR, Kasper J, Van Der Aa S, Andeweg AC, Zaaraoui-Boutahar F, Goeijenbier M, et al. Influenza virus damages the alveolar barrier by disrupting epithelial cell tight junctions. Eur Respir J. (2016) 47:954–66. doi: 10.1183/13993003.01282-2015
43. McMullin B, Atkinson P, Larivée N, Chin CJ. Examining seasonal variation in epistaxis in a maritime climate. J Otolaryngol Head Neck Surg. (2019) 48:74. doi: 10.1186/s40463-019-0395-y
44. Habibi MS, Thwaites RS, Chang M, Jozwik A, Paras A, Kirsebom F, et al. Neutrophilic inflammation in the respiratory mucosa predisposes to RSV infection. Science. (2020) 370:eaba9301. doi: 10.1126/science.aba9301
45. Negus VE. Humidification of the air passages. Acta Otolaryngol. (1952) 41:74–83. doi: 10.3109/00016485209136866
46. Principi N, Esposito S. Nasal irrigation: an imprecisely defined medical procedure. Int J Environ Res Public Health. (2017) 14:516. doi: 10.3390/ijerph14050516